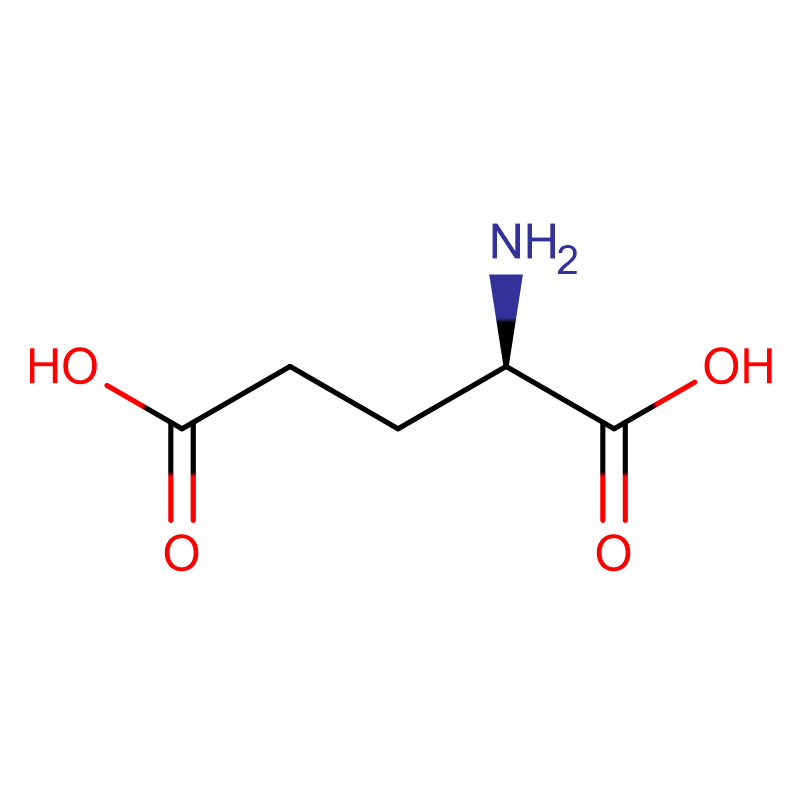
D-Glutamic acid CAS:6893-26-1 99% ຜົງຂາວ
| ໝາຍເລກລາຍການ | XD90313 |
| ຊື່ຜະລິດຕະພັນ | ອາຊິດ D-Glutamic |
| CAS | 6893-26-1 |
| ສູດໂມເລກຸນ | C5H9NO4 |
| ນ້ຳໜັກໂມເລກຸນ | 147.13 |
| ລາຍລະອຽດການເກັບຮັກສາ | ບັນຍາກາດ |
| ລະຫັດພາສີທີ່ສອດຄ່ອງກັນ | 29224200 |
ຂໍ້ມູນຈໍາເພາະຂອງຜະລິດຕະພັນ
| ຮູບລັກສະນະ | ຜົງຜລຶກສີຂາວ |
| ວິເຄາະ | 99% |
| ພືດຫມູນວຽນສະເພາະ | -31 ຫາ -32.2 |
| ໂລຫະຫນັກ | <10ppm |
| AS | <1 ppm |
| pH | 3 - 3.5 |
| SO4 | <0.020% |
| Fe | <10ppm |
| ການສູນເສຍເວລາແຫ້ງ | <0.20% |
| ຕົກຄ້າງຢູ່ໃນຈຸດໄຟ | <0.10% |
| NH4 | <0.02% |
| Cl | <0.02% |
| ສະພາບການແກ້ໄຂ | >98% |
γ-Glutamyltranspeptidases (γ-GTs) ແຍກພັນທະບັດ γ-glutamyl amide ຂອງ glutathione ແລະໂອນກຸ່ມγ-glutamyl ທີ່ປ່ອຍອອກມາໃຫ້ນ້ໍາ (hydrolysis) ຫຼືອາຊິດ amino ທີ່ຍອມຮັບ (transpeptidation).enzymes ຢູ່ທົ່ວທຸກແຫ່ງເຫຼົ່ານີ້ມີບົດບາດສໍາຄັນໃນ biosynthesis ແລະການເຊື່ອມໂຊມຂອງ glutathione, ແລະໃນການ detoxification xenobiotic.ໃນທີ່ນີ້ພວກເຮົາລາຍງານໂຄງສ້າງໄປເຊຍກັນຄວາມລະອຽດ 3Å ຂອງ Bacillus licheniformis γ-GT (BlGT) ແລະທີ່ຊັບຊ້ອນຂອງມັນກັບ l-Glu.ໂຄງສ້າງ X-ray ຢືນຢັນວ່າ BlGT ເປັນຂອງ N-terminal nucleophilic hydrolase superfamily ແລະເປີດເຜີຍໃຫ້ເຫັນວ່າທາດໂປຼຕີນມີ cleft ສະຖານທີ່ເປີດການເຄື່ອນໄຫວທີ່ຄ້າຍຄືກັນກັບລາຍງານສໍາລັບ enzyme homologous ຈາກ Bacillus subtilis, ແຕ່ແຕກຕ່າງຈາກສິ່ງທີ່ສັງເກດເຫັນສໍາລັບ γ-GT ຂອງມະນຸດແລະ. ສໍາລັບ γ-GTs ຈາກຈຸລິນຊີອື່ນໆ.ຂໍ້ມູນແນະນໍາວ່າການຜູກມັດຂອງ l-Glu ເຮັດໃຫ້ເກີດການຈັດລໍາດັບໃຫມ່ຂອງຫາງ C-terminal ຂອງ subunit ຂະຫນາດໃຫຍ່ BlGT ແລະອະນຸຍາດໃຫ້ການກໍານົດຂອງກຸ່ມຂອງອາຊິດ residues ທີ່ອາດຈະມີສ່ວນຮ່ວມໃນການຮັບຮູ້ຂອງ ion ໂລຫະ.ບົດບາດຂອງສານຕົກຄ້າງເຫຼົ່ານີ້ຕໍ່ກັບຄວາມໝັ້ນຄົງຂອງ BlGT ໄດ້ຖືກສຶກສາໂດຍລັກສະນະຂອງການປຸງແຕ່ງອັດຕະໂນມັດ, ກິດຈະກໍາ enzymatic, ສານເຄມີແລະຄວາມຮ້ອນ denaturation ຂອງສີ່ mutants ດຽວ Ala ໃຫມ່.ຜົນໄດ້ຮັບສະແດງໃຫ້ເຫັນວ່າການທົດແທນ Asp568 ດ້ວຍ Ala ມີຜົນກະທົບຕໍ່ການປຸງແຕ່ງອັດຕະໂນມັດແລະຄວາມຫມັ້ນຄົງຂອງໂຄງສ້າງຂອງທາດໂປຼຕີນ.